ऊर्जा स्तर
- इलेक्ट्रॉन शेल या ऊर्जा का स्तर एक परमाणु के नाभिक से निर्दिष्ट दूरी होगी जहां इलेक्ट्रॉनों को पाया जा सकता है या पाए जाने की उच्चतम संभावना है। इलेक्ट्रॉन एक अणु के भीतर नकारात्मक रूप से आवेशित कण होते हैं जो सकारात्मक नाभिक को गोल करते हैं, आमतौर पर केंद्र में स्थित होते हैं। ऊर्जा का स्तर कुछ हद तक एक कदम के इलेक्ट्रॉन छलांग के उपायों की तरह है।
- एक परमाणु की सबसे मौलिक अवधारणाओं में; एक नाभिक के चारों ओर इलेक्ट्रॉनों की परिक्रमा करना।
- हालांकि, इलेक्ट्रॉन अपनी इच्छा के अनुसार किसी भी कक्षा को चुनने में सक्षम नहीं हैं। इलेक्ट्रॉनों को केवल एक निश्चित ऊर्जा स्तर के साथ कक्षाओं तक सीमित किया जाता है। इलेक्ट्रॉन केवल एक ऊर्जा स्तर से कूदने या दूसरे स्तर पर कदम रखने में सक्षम होते हैं। इलेक्ट्रॉन निर्दिष्ट ऊर्जा स्तरों के अलावा किसी भी ऊर्जा के साथ परिक्रमा नहीं कर सकते हैं।
ऊर्जा स्तर आरेख क्या है?
ऊर्जा स्तर का मतलब ऊर्जा इलेक्ट्रॉन की मात्रा के मूल्यांकन की आवश्यकता हो सकती है और संक्रमण के दौरान जारी किया जाएगा, अगर वे एक कक्षा से दूसरे में कूदते हैं। जमीन या शून्य-स्थिति, एच के लिए गणना की जाने वाली न्यूनतम ऊर्जा स्थिति है2 अणुओं।

चार ऊर्जा स्तर क्या हैं?
चार तरह के ऑर्बिटल्स हैं- s, p, d, और f।
- तेज-एस
- सिद्धांत- p
- डिफ्यूज़-डी
- मौलिक-च
एक परमाणु में, इनमें से कुछ संयोजन होते हैं कक्षाओं.
ऊर्जा स्तर अंतरिक्ष या क्षेत्रों की एक मात्रा है, जहाँ भी इलेक्ट्रॉनों शायद मौजूद होगा। ये दूरी, जिसे ऑर्बिटल्स के रूप में जाना जाता है, एक अक्षर (s, p, d, f) द्वारा निरूपित विभिन्न आकृतियों के होते हैं।

गीक३, परमाणु-कक्षीय-बादल spdf m0, सीसी द्वारा एसए 4.0
आप ऊर्जा का स्तर कैसे निर्धारित करते हैं?

ब्रूसबलौस, Blausen 0342 इलेक्ट्रॉन ऊर्जा स्तर, सीसी द्वारा 3.0
अणु की संयोजन क्षमता
"इलेक्ट्रॉन वे उच्चतम ऊर्जा स्तर में होते हैं जिन्हें वैलेंस इलेक्ट्रॉन कहा जाता है।"
निम्नतम अवस्था
"एच की न्यूनतम ऊर्जा संतुलन राज्य2 परमाणु को भू-अवस्था के रूप में स्वीकार किया जाता है। ”
उत्साहित राज्य
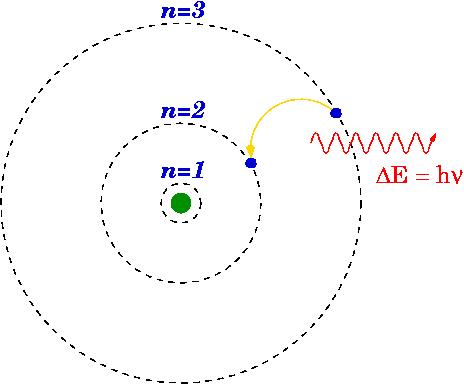
जब इलेक्ट्रॉन (या परमाणु) में इस सबसे कम ऊर्जा की तुलना में अधिक ऊर्जा होती है, तो इसे "उत्तेजित अवस्था" में कहा जाता है।
यदि इलेक्ट्रॉन उच्च स्तर से निचले स्तर तक गिरता है, तो एक फोटॉन निकल सकता है, या ऊर्जा निकल सकती है।
ऊर्जा अंतर
उत्सर्जित फोटॉन की ऊर्जा प्राथमिक (एन) के ऊर्जा स्तरों में अंतर है i ) और अंतिम (एन f ) राज्य। उत्सर्जित फोटॉन की ऊर्जा की गणना Rydberg Formula के उपयोग से की जाती है।
हाइड्रोजन का बोह्र मॉडल
1913 में, नील्स बोहर ने ऊर्जा के स्तर और वर्णक्रमीय फ्रीक की अवधारणा कीn एच के2 काल्पनिक शास्त्रीय को ठीक करने के लिए विभिन्न सरल धारणा पर विचार करना। इन दोषों में से अधिकांश को अर्नोल्ड समरफ़ील्ड द्वारा बोहर मॉडल के संशोधन द्वारा हल किया गया था। इस मॉडल के लिए, भौतिक विज्ञानी नील्स बोहर को वर्ष 1922 में भौतिकी का नोबेल पुरस्कार मिला है।
मूलभूत अवधारणा में कि एक परमाणु (बोहर परमाणु मॉडल), इलेक्ट्रॉन नाभिक के चारों ओर केवल कुछ कक्षाओं की परिक्रमा कर रहे हैं। ऊर्जा के उत्सर्जन या अवशोषण के अलावा, अनुमत कक्षाओं के बीच नीचे और ऊपर जाने वाले इलेक्ट्रॉन होते हैं।
यद्यपि इस मूल मॉडल को अच्छी तरह से स्वीकार नहीं किया गया है, क्योंकि अधिकांश परमाणुओं की संरचना हाइड्रोजन की तुलना में अधिक जटिल है, हालांकि यह नए विषयों की आवश्यकता है, इसलिए क्वांटम यांत्रिकी में, क्वांटम यांत्रिकी में, प्रत्येक परिक्रमा इलेक्ट्रॉन को गणितीय रूप से जाना जाता है। एक लहर समारोह।
विलो, बोहर परमाणु मॉडल, सीसी द्वारा एसए 3.0
बोहर रेडियस
"बोहर त्रिज्या (a0) एक स्थिर पैरामीटर है, जो नाभिक और इलेक्ट्रॉन के बीच जमीन की स्थिति (गैर-सापेक्षतावादी और असीम रूप से भारी प्रोटॉन वाले) के बीच हाइड्रोजन परमाणु के लिए सबसे अधिक अनुमानित दूरी के बराबर है।"
परमाणु के बोह्र मॉडल में इसका हिस्सा होने के कारण इसका नाम नील्स बोह्र रखा गया है।

SE3-29X, हाइड्रोजन GIF, सीसी द्वारा एसए 4.0
वर्णक्रमीय रेखाएँ
प्रत्येक घटक में ऊर्जा स्तरों का एक विशेष समूह होता है। इस प्रकार, वह आवृत्तियाँ जिसमें यह अवशोषित होता है और प्रकाश उत्सर्जित करता है, एक प्रकार के माइक के रूप में व्यवहार करता है, जो विशिष्ट यौगिक और विशेष की पहचान करता है। परमाणुओं की इन विशेषताओं ने स्पेक्ट्रोस्कोपी नामक विषयों में जांच की है, अणुओं और परमाणुओं की पहचान करने के लिए समर्पित एक विज्ञान जो वे अवशोषित या उत्सर्जन करते हैं।
बालेमर सीरीज़
परमाणु भौतिक विज्ञानी बाल्मर ने विश्लेषणात्मक रूप से परमाणु से फोटॉन जारी करने के दौरान ऊर्जा में एक संबंध का उल्लेख किया है। विभिन्न असतत फोटोन ऊर्जा / तरंगदैर्ध्य जो बालमर द्वारा खोजे गए थे, उन्हें बाल्मर श्रृंखला कहा जाता है।
यह बाद में ज्ञात हुआ कि ऊर्जा संक्रमण हाइड्रोजन परमाणु से बाल्मर रेखाएँ बनाता है। परमाणु के बोह्र मॉडल ने बामर श्रृंखला को बनाने में कामयाबी हासिल की क्योंकि बड़ी कक्षाओं को कोणीय गति के साथ संतुलन बनाने के लिए काफी अधिक प्रतिकूल शक्ति या नकारात्मक ऊर्जा की आवश्यकता होती है। Rydberg फॉर्मूला सभी एनर्जी समायोजन के लिए बामर श्रृंखला का एक व्यापक दृष्टिकोण रखता है।
उत्सर्जन चित्र
RSI उत्सर्जन चित्र परमाणु हाइड्रोजन को मानक Rydberg सूत्र द्वारा प्रदान की गई कई वर्णक्रमीय श्रृंखला और तरंग दैर्ध्य में विभाजित किया गया था। ये पता चला वर्णक्रमीय रेखाएँ एक परमाणु में विभिन्न ऊर्जा स्तरों से इलेक्ट्रॉन संक्रमण का परिणाम हैं।
एक उत्सर्जन स्पेक्ट्रम एक परमाणु या रासायनिक यौगिक द्वारा उत्सर्जित तरंग दैर्ध्य की विविधता को दर्शाता है जो या तो ताप या विद्युत प्रवाह द्वारा प्रेरित होता है। जलने वाले गैस या अन्य अणुओं के उत्सर्जन स्पेक्ट्रम का उपयोग इसकी संरचना के लिए भी किया जा सकता है।
छवि क्रेडिट: रंजीथजी, हीलियम का परमाणु उत्सर्जन स्पेक्ट्रम, सीसी द्वारा एसए 4.0
स्थितिज ऊर्जा
“यह अन्य वस्तुओं, तनावों, संग्रहीत विद्युत प्रभार या अन्य कारकों के सापेक्ष अपनी स्थिति के लिए एक इकाई की ऊर्जा है खुद के भीतर। ”
बंधन ऊर्जा
"बाध्यकारी ऊर्जा एक नाभिक को एक साथ रखने के लिए आवश्यक न्यूनतम ऊर्जा है।"
आयनीकरण ऊर्जा
"जमीन इलेक्ट्रॉनिक राज्य में एक पृथक परमाणु को एक ई के रूप में छुट्टी पाने के लिए अवशोषित करने के लिए आवश्यक ऊर्जा की मात्रा
आयनन ऊर्जा को एक परमाणु या आयन में एक इलेक्ट्रॉन को निकालने में कठिनाई का एक कदम या इलेक्ट्रॉन को आत्मसमर्पण करने के लिए एक परमाणु या आयन की दक्षता के रूप में वर्णित किया जाता है। इलेक्ट्रॉन की कमी की कोई भी प्रजाति आमतौर पर जमीन की स्थिति में नहीं होती है।
आयनीकरण ऊर्जाओं को केजे / मोल में मापा जाता है, या एक मोल में सभी परमाणुओं के लिए ऊर्जा की मात्रा की आवश्यकता होती है, ताकि एकता को क्रमशः ढीला किया जा सके।
आयनीकरण ऊर्जा कैसे काम करती है?
आयनियोजन ऊर्जा आवश्यक ऊर्जा है, जिसमें एक इलेक्ट्रॉनिक इलेक्ट्रॉनिक रिलीज को अवशोषित करने के लिए जमीन इलेक्ट्रॉनिक राज्य से एक पृथक, गैसीय परमाणु होना चाहिए। जितने अधिक इलेक्ट्रॉनों की हार होगी, यह आयन उतना ही अधिक होगा, और परमाणु से ई को अलग करना अधिक कठिन होगा।
किस तत्व में सबसे अधिक और सबसे कम आयनीकरण ऊर्जा होती है?
- तत्व वह सबसे अधिक आयनीकरण ऊर्जा है।
- फ्रेंशियम में न्यूनतम आयनीकरण ऊर्जा होती है।
एक तत्व की आयनीकरण ऊर्जा एक आवर्त-सारणी में बाईं से दाईं ओर ऊँची हो जाती है और आवर्त सारणी में आम तौर पर ऊपर से नीचे तक गिरावट आती है।
कडांगो और एड्रिग्नोला, आयनीकरण ऊर्जा आवर्त सारणी, सीसी द्वारा एसए 3.0
इलेक्ट्रॉन क्लाउड के बारे में अधिक जानकारी के लिए यहां क्लिक करें
यह भी पढ़ें:
- क्या स्थितिज ऊर्जा संचित ऊर्जा है
- गतिज ऊर्जा के प्रकार
- विद्युत ऊर्जा से दीप्तिमान ऊर्जा का उदाहरण
- यांत्रिक से विद्युत ऊर्जा का उदाहरण
- गुरुत्वाकर्षण ऊर्जा से यांत्रिक ऊर्जा
- पवन ऊर्जा सूत्र
- क्या द्रव्यमान स्थितिज ऊर्जा को प्रभावित करता है?
- दीप्तिमान ऊर्जा से रासायनिक ऊर्जा
- रासायनिक ऊर्जा से ध्वनि ऊर्जा
- ध्वनि ऊर्जा की गतिज का उदाहरण

मैं सुब्रत, पीएच.डी. हूं। इंजीनियरिंग में, विशेष रूप से परमाणु और ऊर्जा विज्ञान से संबंधित डोमेन में रुचि रखते हैं। मेरे पास इलेक्ट्रॉनिक्स ड्राइव और माइक्रो-कंट्रोलर के लिए सर्विस इंजीनियर से लेकर विशेष अनुसंधान एवं विकास कार्य तक का मल्टी-डोमेन अनुभव है। मैंने विभिन्न परियोजनाओं पर काम किया है, जिनमें परमाणु विखंडन, संलयन से लेकर सौर फोटोवोल्टिक्स, हीटर डिजाइन और अन्य परियोजनाएं शामिल हैं। मुझे विज्ञान क्षेत्र, ऊर्जा, इलेक्ट्रॉनिक्स और उपकरण, और औद्योगिक स्वचालन में गहरी रुचि है, मुख्य रूप से इस क्षेत्र में विरासत में मिली उत्तेजक समस्याओं की विस्तृत श्रृंखला के कारण, और हर दिन यह औद्योगिक मांग के साथ बदल रहा है। यहां हमारा उद्देश्य इन अपरंपरागत, जटिल विज्ञान विषयों को आसान और समझने योग्य तरीके से प्रस्तुत करना है।
