इस लेख में, "नाइट्रिक एसिड लुईस संरचना", लुईस संरचना ड्राइंग प्रक्रिया, कुछ विस्तृत स्पष्टीकरण के साथ कुछ गुणों पर संक्षेप में चर्चा की गई है।
नाइट्रिक एसिड मूल रूप से एक आयनिक यौगिक है जिसमें H . होता है+ और नहीं3- आयन नाइट्रोजन और ऑक्सीजन में क्रमशः 7 और 8 इलेक्ट्रॉन होते हैं। इनमें से केवल संयोजी इलेक्ट्रॉनों को संबंधित परमाणुओं के चारों ओर दिखाया जाता है और शेष इलेक्ट्रॉन सहसंयोजक बंधन निर्माण में भाग लेते हैं।
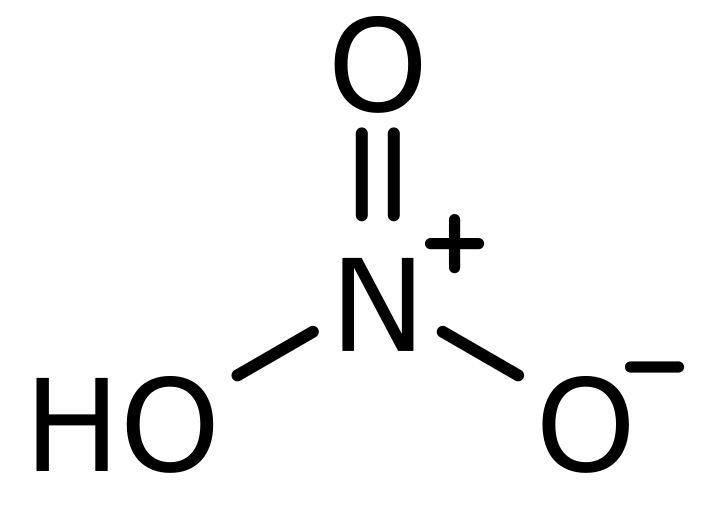
इस लेख का मुख्य दृष्टिकोण नीचे दिखाए गए नाइट्रिक एसिड की लुईस डॉट संरचना को आकर्षित और विश्लेषण करना है।
लुईस संरचना क्या है?
लुईस की संरचना या लुईस डॉट संरचना के रूप में जाना जाता है, किसी भी अणु का एक प्रकार का प्रतिनिधित्व संबंधित प्रजातियों के आसपास वैलेंस शेल इलेक्ट्रॉनों और परमाणुओं से जुड़े बंधनों के साथ होता है।
लुईस डॉट संरचना इसका नाम सबसे पहले प्रख्यात वैज्ञानिक गिल्बर्ट के नाम पर रखा गया था। एन लुईस। उन्होंने सबसे पहले इसका परिचय दिया लुईस संरचना 1916 के वर्ष में "द एटम एंड द मोलेक्यूल" नामक उनके लेख में अवधारणा।
लुईस की संरचना वास्तव में संरचना, सहसंयोजक बंधन या गठन में भाग लेने वाले इलेक्ट्रॉनों की संख्या के साथ-साथ इलेक्ट्रॉनों को गैर-बंधुआ जोड़े के रूप में निर्धारित करने में मदद करता है। ये सभी में दिखाए गए हैं लुईस संरचना. यह एक विशेष आणविक प्रजाति में प्रत्येक परमाणु के औपचारिक प्रभार की गणना करने का एक तरीका भी देता है।
लुईस संरचना खींचने की प्रक्रिया
कुछ बिंदुओं का पालन किया जाना चाहिए लुईस संरचना ड्रा जिन्हें नीचे समझाया गया है-
- पहले प्रत्येक प्रजाति के परमाणु क्रमांक और संयोजक इलेक्ट्रॉनों की संख्या की गणना की जाएगी।
- ऑक्टेट को भरने के लिए इलेक्ट्रॉनों की संख्या या उस प्रजाति के वैलेंस शेल को भरने के लिए आवश्यक इलेक्ट्रॉनों की संख्या प्रत्येक परमाणु के लिए गिना जाता है लुईस संरचना ड्रा.
- उस अणु में मौजूद सहसंयोजक या आयनिक बंधों की संख्या भी निर्धारित की जानी चाहिए।
- उपरोक्त मापदंडों को निर्धारित करने के बाद, अणु के कंकाल की संरचना को वैलेंस शेल इलेक्ट्रॉनों और अणु में मौजूद बांडों को दिखाते हुए तैयार किया जाएगा।

इसमें ऊपर लुईस संरचना कार्बन डाइऑक्साइड की, ऑक्सीजन के अबंधित इलेक्ट्रॉनों को ऑक्सीजन परमाणुओं के चारों ओर दिखाया गया है। इसमें कुल आठ इलेक्ट्रॉन और इलेक्ट्रॉन विन्यास 1s2 2s2 2p4 है। कुल संयोजकता इलेक्ट्रॉन छह है। इन छह इलेक्ट्रॉनों में से दो इलेक्ट्रॉन कार्बन के साथ सहसंयोजक बंधन निर्माण में भाग लेते हैं। शेष चार इलेक्ट्रॉनों को दो ऑक्सीजन परमाणुओं में से प्रत्येक के चारों ओर गैर-बंधित इलेक्ट्रॉनों के रूप में दिखाया गया है।
कार्बन का परमाणु क्रमांक छह है ऋणावेशित सूक्ष्म अणु का विन्यास 1s2 2s2 2p2. इस प्रकार, इसमें चार सबसे बाहरी शेल इलेक्ट्रॉन होते हैं और सभी वैलेंस इलेक्ट्रॉनों का उपयोग चार . बनाने के लिए किया जाता है दो ऑक्सीजन परमाणुओं के साथ सहसंयोजक बंधन. तो, कार्बन परमाणुओं के आसपास कोई इलेक्ट्रॉन नहीं दिखाया गया है।
नाइट्रिक एसिड लुईस संरचना
नाइट्रिक एसिड, जिसे एक्वा फोर्टिस (अंग्रेजी अर्थ मजबूत पानी) के रूप में जाना जाता है, एक बहुत मजबूत अकार्बनिक एसिड होता है दाढ़ जन 63.012 g/mol और घनत्व 1.41 g/cm3. लुईस संरचना ऊपर बताए गए तरीकों का उपयोग करके भी नाइट्रिक एसिड निकाला जा सकता है।

नाइट्रिक एसिड में तीन प्रकार के परमाणु होते हैं, हाइड्रोजन, ऑक्सीजन और नाइट्रोजन। ऑक्सीजन और नाइट्रोजन में क्रमशः आठ और छह इलेक्ट्रॉन होते हैं। ऑक्सीजन के सबसे बाहरी कोश में कुल छह इलेक्ट्रॉन होते हैं और नाइट्रोजन के सबसे बाहरी कोश में पांच इलेक्ट्रॉन होते हैं।
ऑक्सीजन परमाणुओं को क्रमशः 1,2,3 के रूप में निरूपित किया जाता है। इन इलेक्ट्रॉनों में, नंबर 1 ऑक्सीजन ने नाइट्रोजन और हाइड्रोजन के साथ सहसंयोजक बंधन गठन में अपने चार इलेक्ट्रॉनों (8 वैलेंस इलेक्ट्रॉनों के बीच) को दर्शाया। इसी तरह का मामला नंबर 3 निरूपित ऑक्सीजन के लिए भी देखा गया है। लेकिन अलग परिदृश्य संख्या 2 निरूपित ऑक्सीजन के लिए है। इस ऑक्सीजन में, छह इलेक्ट्रॉनों को ऑक्सीजन परमाणुओं के चारों ओर अबंधित दिखाया जाता है और ऋणात्मक हो जाता है।
नाइट्रोजन के संयोजकता कोश में पाँच इलेक्ट्रॉन होते हैं और यह इन पाँच सबसे बाहरी शेल इलेक्ट्रॉनों में से चार का उपयोग ऑक्सीजन के तीन परमाणुओं के साथ बंध निर्माण में करता है और +1 हो जाता है।
नाइट्रिक एसिड की औपचारिक शुल्क गणना
संपूर्ण आणविक प्रजाति में प्रत्येक परमाणु के औपचारिक आवेश की गणना निम्न सूत्र का उपयोग करके की जा सकती है-
- औपचारिक आवेश = संयोजी इलेक्ट्रॉनों की कुल संख्या - इलेक्ट्रॉनों की संख्या अबंधित रहती है - (बंध निर्माण में शामिल इलेक्ट्रॉनों की संख्या/2)
- नंबर 1 और नंबर 3 पर औपचारिक चार्ज ऑक्सीजन को दर्शाता है = 6 - 4 - (4/2) = 0
- संख्या 2 का औपचारिक प्रभार निरूपित ऑक्सीजन = 6 - 6 - (2/2) = -1
- नाइट्रोजन पर औपचारिक आवेश = 5 - 0 - (8/2) = +1
- हाइड्रोजन पर औपचारिक आवेश = 1 - 0 - (2/2) = 0
छवि क्रेडिट: विकिमीडिया कॉमन्स
अक्सर पूछे जाने वाले प्रश्न (FAQ)
क्या नाइट्रिक अम्ल जल के साथ अभिक्रिया करता है?
उत्तर: नाइट्रिक अम्ल जल में अपघटित होकर नाइट्रोजन डाइऑक्साइड में अपघटित हो जाता है (NO .)2), ऑक्सीजन (O)2) और परिणामी विलयन का रंग पीला हो जाता है।
HNO3 = नहीं2 + ओ2 + एच2O
क्या नाइट्रिक अम्ल धातु के साथ अभिक्रिया करता है?
उत्तर: नाइट्रिक अम्ल धातु के साथ अभिक्रिया करके हाइड्रोजन गैस मुक्त करता है (H .)2) नाइट्रिक एसिड के साथ प्रतिक्रिया के बाद मैग्नीशियम (Mg) मैग्नीशियम नाइट्रेट बनाता है [Mg (सं।)3)2] और हाइड्रोजन गैस.
मिलीग्राम + एचएनओ3 = Mg (सं।)3)2 + एच2
यह भी पढ़ें:
- एसिटिक एसिड लुईस संरचना
- Na2so4 लुईस संरचना
- Seo2 लुईस संरचना
- Hio3 लुईस संरचना
- Hpo4 2 लुईस संरचना
- Brcl5 लुईस संरचना
- Mg2 लुईस संरचना
- कोई लुईस संरचना नहीं
- NH2F लुईस संरचना
- Al3 लुईस संरचना

नमस्ते,
मैं अदिति रे हूं, इस मंच पर एक रसायन विज्ञान एसएमई। मैंने कलकत्ता विश्वविद्यालय से रसायन विज्ञान में स्नातक और अकार्बनिक रसायन विज्ञान में विशेषज्ञता के साथ टेक्नो इंडिया विश्वविद्यालय से स्नातकोत्तर की पढ़ाई पूरी की है। मैं लैंबडागीक्स परिवार का हिस्सा बनकर बहुत खुश हूं और मैं इस विषय को सरल तरीके से समझाना चाहूंगा।
आइए लिंक्डइन के माध्यम से जुड़ें-https://www.linkedin.com/in/aditi-ray-a7a946202
