सिलिकॉन टेट्राफ्लोराइड (SiF4) में 4 वैलेंस इलेक्ट्रॉनों वाला एक केंद्रीय सिलिकॉन (Si) परमाणु होता है, जो चार फ्लोरीन (F) परमाणुओं के साथ एकल बंधन बनाता है, प्रत्येक 7 वैलेंस इलेक्ट्रॉनों का योगदान देता है। लुईस संरचना 8 बॉन्डिंग इलेक्ट्रॉनों का उपयोग करते हुए, चार सी-एफ बॉन्ड और सिलिकॉन पर कोई अकेला जोड़ा नहीं दिखाती है। SiF4 लगभग 109.5° के बंधन कोणों के साथ टेट्राहेड्रल ज्यामिति को अपनाता है, जो एसपी³ संकरण की विशेषता है। फ्लोरीन की उच्च इलेक्ट्रोनगेटिविटी (3.98) के बावजूद, अणु अपने सममित आकार के कारण गैर-ध्रुवीय है। यह संरचना और Si-F बांड की ताकत SiF4 के रासायनिक गुणों को महत्वपूर्ण रूप से प्रभावित करती है, जिसमें अर्धचालक उद्योग में इसकी प्रतिक्रियाशीलता और भूमिका भी शामिल है।

आइए इस लेख में निम्नलिखित बिंदुओं पर चर्चा करें
- SIF4 के लिए लुईस संरचना कैसे बनाएं?
- SIF4 लुईस संरचना अकेला जोड़े
- SIF4 लुईस संरचना आकार:
- SIF4 लुईस संरचना ऑक्टेट नियम
- SIF4 संकरण
- SIF4 लुईस संरचना प्रतिध्वनि
- SIF4 ध्रुवीय या गैर-ध्रुवीय
- SIF4 लुईस संरचना औपचारिक शुल्क
- SIF4 लुईस संरचना आकार:
SIF4 के लिए लुईस संरचना कैसे बनाएं?
अणु का आकार संयोजकता इलेक्ट्रॉन बंध युग्म या अबंध युग्म के बीच प्रतिकर्षण पर निर्भर करता है। SIF4 अणु में, चार फ्लोरीन परमाणु एक केंद्रीय सिलिकॉन परमाणु से घिरे होते हैं। सिलिकॉन परमाणु में चार अयुग्मित इलेक्ट्रॉन होते हैं,
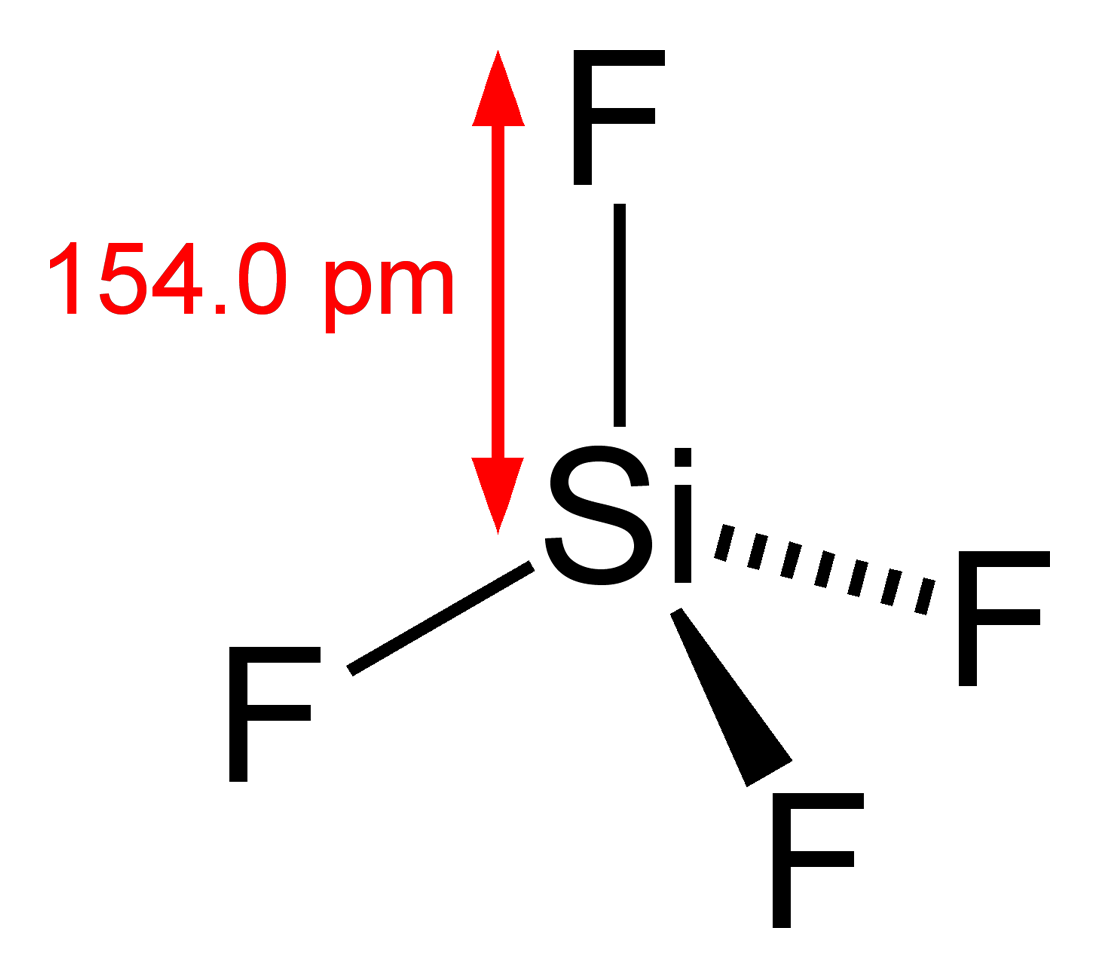
अष्टक नियम के अनुसार सिलिकॉन को अपना अष्टक पूरा करने के लिए चार अन्य परमाणुओं के साथ जोड़ा जाता है। अतः चार Si-F आबंध बनाते हैं। VSEPR सिद्धांत के अनुसार, SiF4 अणु चतुष्फलकीय ज्यामिति को दर्शाता है, जिसमें बंध कोण 109.5 . हैo और बांड की लंबाई 154 बजे है।
SIF4 लुईस संरचना अकेला जोड़े
एक सिलिकॉन परमाणु का संयोजकता इलेक्ट्रॉन= 4×1=4
चार फ्लोरीन परमाणुओं का संयोजकता इलेक्ट्रॉन = 7×4=28
कुल संयोजकता इलेक्ट्रॉन = 32 एक स्थिर के लिए 16 जोड़े इलेक्ट्रॉनों की आवश्यकता होती है लुईस की संरचना.
उपरोक्त संरचना में, हमारे पास चार Si-F बांड के साथ 16 इलेक्ट्रॉन जोड़े हैं, इसलिए 12 इलेक्ट्रॉन बने रहते हैं जो कि एकाकी जोड़े द्वारा निरूपित होते हैं, प्रत्येक फ्लोरीन परमाणु के लिए तीन एकाकी जोड़े होते हैं इसलिए सिलिकॉन के चारों ओर कुल 12 एकाकी जोड़े इलेक्ट्रॉन मौजूद होते हैं। परमाणु,
और सिलिकॉन में इलेक्ट्रॉन की शून्य जोड़ी होती है क्योंकि सभी 12 इलेक्ट्रॉन जोड़े चार फ्लोरीन परमाणु के आसपास मौजूद होते हैं।
SIF4 लुईस संरचना आकार:

SIF4 लुईस संरचना ऑक्टेट नियम
ऊपरोक्त में लुईस की संरचनासिलिकॉन और फ्लोरीन में कोई चार्ज नहीं होता है और केंद्रीय सिलिकॉन परमाणु अपना ऑक्टेट पूरा करता है इसलिए यह संरचना एक स्थिर लुईस संरचना है। एक स्थिर लुईस संरचना के लिए, उपस्थित अणुओं के सभी परमाणुओं को अष्टक नियम को पूरा करना चाहिए,
ऑक्टेट नियम में कहा गया है कि एक परमाणु के स्थिर विन्यास को प्राप्त करने के लिए आठ इलेक्ट्रॉन होते हैं जो निकटतम महान गैस के इलेक्ट्रॉनिक विन्यास के समान होते हैं।
SiF4 अणु में, फ्लोरीन परमाणु को अपना ऑक्टेट पूरा करने के लिए केवल एक इलेक्ट्रॉन की आवश्यकता होती है जबकि सिलिकॉन परमाणु को अपना ऑक्टेट पूरा करने और स्थिर होने के लिए चार इलेक्ट्रॉनों की आवश्यकता होती है। सिलिकॉन और फ्लोरीन परमाणु एक-दूसरे के साथ एक इलेक्ट्रॉन साझा करते हैं और अपना ऑक्टेट पूरा करते हैं, हाइड्रोजन में दो वैलेंस इलेक्ट्रॉन होते हैं और सिलिकॉन में आठ वैलेंस इलेक्ट्रॉन होते हैं, इस तरह वे अपना ऑक्टेट पूरा करते हैं।
SIF4 संकरण
हाइब्रिडाइजेशन एक ऐसी प्रक्रिया है जिसमें एक अणु में दोनों परमाणुओं के परमाणु ऑर्बिटल्स एक साथ आते हैं और एक दूसरे के साथ मिलकर एक हाइब्रिड ऑर्बिटल बनाते हैं जो सीधे ओवरलैपिंग सिग्मा बॉन्ड बनाते हैं जबकि साइड टू साइड पैरेलल ओवरलैप एक पाई बॉन्ड बनाते हैं।
SiH4 अणु में सिलिकॉन का इलेक्ट्रॉनिक विन्यास है,
सी: 1s2 2s2 2p6 3s2 3p2
सी: [एआर] 3 एस2 3p2

उपरोक्त आरेख से, s कक्षीय और तीन p कक्षीय एक साथ आते हैं और मिलकर 4 संकरणित 3p . बनाते हैं3 ऑर्बिटल्स ये 4 हाइब्रिड ऑर्बिटल्स चार हाइड्रोजन परमाणुओं के साथ चार सिग्मा बॉन्ड बनाते हैं। इसलिए, SiH3 में Si का संकरण sp4 है।
SIF4 लुईस संरचना प्रतिध्वनि
अनुनाद एक रासायनिक घटना है जिसमें अणु के संपूर्ण गुणों को एक संरचना से स्पष्ट नहीं किया जा सकता है। इसमें कई विहित संरचनाएँ शामिल हैं। लेकिन हर अणु प्रतिध्वनि प्रदर्शित नहीं कर सकता।
सीआईएफ4 लुईस संरचना अनुनाद प्रदर्शित नहीं करता है क्योंकि इलेक्ट्रॉनों का कोई निरूपण नहीं होता है और एकल बंधों की उपस्थिति होती है। इसलिए कोई हलचल नहीं है। भले ही इलेक्ट्रॉनों के अकेले जोड़े की उपस्थिति हो, लेकिन निरूपण स्थिरता कारक को परेशान करता है। इसलिए कोई प्रतिध्वनि नहीं हैं SiFl4 लुईस की संरचनाएं संरचना
SIF4 ध्रुवीय या गैर-ध्रुवीय
चार फ्लोरीन परमाणु SiF4 अणु में एक केंद्रीय सिलिकॉन परमाणु से घिरे होते हैं, सिलिकॉन परमाणु की इलेक्ट्रोनगेटिविटी 1.90 है और फ्लोरीन परमाणु की इलेक्ट्रोनगेटिविटी 3.98 है फ्लोरीन और सिलिकॉन की इलेक्ट्रोनगेटिविटी के बीच का अंतर 2.08 है,
सिलिकॉन और फ्लोरीन के बीच इतना इलेक्ट्रोनगेटिविटी अंतर इंगित करता है कि इलेक्ट्रॉन जोड़े फ्लोरीन परमाणु की ओर दृढ़ता से आकर्षित होते हैं इसलिए SiF4 अणु में Si-F बंधन ध्रुवीय होता है। उनके बीच अधिक इलेक्ट्रोनगेटिविटी अंतर इंगित करता है कि इलेक्ट्रॉन जोड़ी फ्लोरीन परमाणु की ओर दृढ़ता से आकर्षित होती है इसलिए Si-F बंधन अत्यधिक ध्रुवीय होता है।
SIF4 लुईस संरचना औपचारिक शुल्क
सिलिकॉन टेट्राफ्लोराइड अणु में वास्तविक आवेशों की संख्या कुल औपचारिक आवेशों से मेल खाती है। औपचारिक शुल्क की गणना SiF4 . द्वारा की जाती है लुईस डॉट संरचना। जिनकी गणना निम्न सूत्र द्वारा की जाती है,
SiF4 अणु के Si परमाणु पर औपचारिक आवेश = सिलिकॉन के सिलोन जोड़ी के वैलेंस इलेक्ट्रॉन -1/2 (इलेक्ट्रॉनों की बंधन जोड़ी)
औपचारिक चार्ज गणना सूत्र के अनुसार, सिलिकॉन परमाणु में 4 वैलेंस इलेक्ट्रॉन, आठ बंधन इलेक्ट्रॉन होते हैं, और कोई अकेला जोड़ा नहीं होता है। अतः SiF4 अणु में SiF4 अणु के सिलिकॉन परमाणु पर औपचारिक आवेश = (4- 0- (8/2)) = 0
अतः SiF4 अणु में औपचारिक आवेश शून्य होते हैं।
SIF4 लुईस संरचना आकार:
SiF4 की चतुष्फलकीय संरचना नीचे दिखाई गई है:
आम सवाल-जवाब
SiF4 की लुईस संरचना क्या है?
उत्तर : में लुईस की संरचना SiF4 अणु का केंद्रीय सिलिकॉन परमाणु चार फ्लोरीन परमाणुओं से घिरा होता है, यह चार Si-F बांड बनाता है, सभी फ्लोरीन परमाणुओं में प्रत्येक पर तीन एकाकी जोड़े होते हैं।
XeO3 और SIF4 की लुईस संरचनाओं के बीच समानताएं और अंतर क्या हैं?
RSI xeo3 लुईस संरचना की व्याख्या की गई पता चलता है कि XeO3 और SiF4 दोनों में केंद्रीय परमाणु इलेक्ट्रॉन जोड़े और बंधन जोड़े से घिरे हुए हैं। हालाँकि, मुख्य अंतर इलेक्ट्रॉन जोड़े और बंधन कोणों की संख्या में है। XeO3 में 3 बंधन जोड़े और 2 एकाकी जोड़े हैं, जिसके परिणामस्वरूप लगभग 109.5° के बंधन कोण के साथ एक त्रिकोणीय पिरामिड आकार बनता है। दूसरी ओर, SiF4 में 4 बंधन जोड़े हैं और कोई अकेला जोड़ा नहीं है, जो इसे 109.5° के बंधन कोण के साथ एक चतुष्फलकीय आकार देता है।
आप SiF4 के आकार की भविष्यवाणी कैसे करते हैं?
उत्तर: SiF4 के आकार की भविष्यवाणी VSEPR सिद्धांत द्वारा की जाती है, केंद्रीय सिलिकॉन परमाणु में चार वैलेंस इलेक्ट्रॉन होते हैं इसलिए यह चार फ्लोरीन परमाणुओं से जुड़ा होता है और टेट्राहेड्रल ज्यामिति बनाता है।
लुईस संरचना का क्या महत्व है?
उत्तर: यह बंधन की प्रकृति और अणु में जुड़े हुए अणु के परमाणुओं की स्थिति को परिभाषित करता है। लुईस इलेक्ट्रॉन डॉट संरचना या सिर्फ लुईस संरचना में अणुओं का प्रतिनिधित्व अमेरिकी रसायनज्ञ गिल्बर्ट न्यूटन लुईस के सम्मान में है।
यह भी पढ़ें:
- Ncl2 लुईस संरचना
- Co2 लुईस संरचना
- बाओ लुईस संरचना
- Sncl2 लुईस संरचना
- H2so4 लुईस संरचना
- Xecl2 लुईस संरचना
- Chf3 लुईस संरचना
- Na2so4 लुईस संरचना
- Bf3 लुईस संरचना
- H2o2 लुईस संरचना

नमस्ते...मैं दर्शन फेंडारकर हूं, मैंने अपनी पीएच.डी. पूरी कर ली है। नागपुर विश्वविद्यालय से. मेरी विशेषज्ञता का क्षेत्र अकार्बनिक रसायन विज्ञान है।
मेरे पास अर्थकेयर प्राइवेट लिमिटेड में केमिस्ट के रूप में अनुभव है। लिमिटेड इसके अलावा मेरे पास शिक्षण में 2 साल का अनुभव है। वर्तमान में, मैं लैम्बडेगीक के साथ विषय विशेषज्ञ के रूप में काम कर रहा हूं।

